- ▶中央一括審査について
- ▶介入研究の審査委託手続き
- ・倫理審査の委受託について
- ・審査依頼(新規申請)の流れ
- ・倫理審査委受託契約について
- ・研究分担機関が行う手続き
- ▶非介入研究の審査委託手続き
- ・倫理審査の委受託について
- ・審査依頼(新規申請)の流れ
- ・研究分担機関が行う手続き
- ▶審査依頼に用いる様式
審査依頼(新規申請)の流れ 介入研究
1.『倫理審査委受託契約書』の取り交わし
始めに倫理審査委受託契約(包括契約)を締結させていただきます。
既に包括契約を締結している場合は、研究計画ごとの契約取り交わしは不要です。
なお、倫理審査の開始は本院での倫理審査依頼受諾手続き後となります。
委受託契約書作成についての詳細は「倫理審査委受託契約について」ページをご参照ください。
※『倫理審査委受託契約書』について、中央一括審査の委受託契約は包括契約をお薦めしていますが、包括契約が難しい場合は課題別契約も可能です。
2.『研究機関要件確認書』
各機関における当該研究課題の実施可能性(設備、人員配置、研究者の教育研修、利益相反管理など)を確認する『研究機関要件確認書』をご提出いただきます。
3.『倫理審査依頼書』
研究機関の長(研究許可権者)から倫理審査の依頼をしていただくため、『倫理審査依頼書』を作成してください。
尚、書面右上の作成日は、『倫理審査委受託契約書』の契約締結日以降の年月日でお願いいたします。
※代表機関はこちらからダウンロードして作成してください。分担施設へは研究事務局よりひな型を送付します。
4. 倫理審査申請システムへ新規申請
倫理審査申請システム(以下、「 Webシステム」といいます。) へ申請を行います。
・初めに、Webシステムに新規申請画面を作成する担当者がログインするために、ユーザー登録を行ってください。
・ログインできましたら、Webシステム画面に必要な情報の入力と提出書類のファイルを添付してください。
なお、中央一括審査では研究計画書など全機関で共通して用いる資料については、代表機関のみ提出していただきます。
(分担施設は共通資料の提出は不要です。)
・各施設の審査資料として、Webシステムに下記書類の添付が必要となりますのでご準備願います。
・利益相反に関する書類:(自由書式)各機関で発行された利益相反自己申告書、または利益相反審査結果通知書等の写し(研究責任者、研究分担者全員分)
・研究者リスト:受講した教育記録を記載したもの(研究責任者、研究分担者全員分)
・研究責任者の履歴書:(自由書式)治験統一書式に準じたもの
・説明同意文書:研究共通のひな形(研究として一つとすることが望ましい)
※審査資料をひな形で提出しない場合は、自施設用説明同意文書(共通ひな形の問合せ窓口などの記載を自施設用に
変更したもの)を添付してください。
・研究機関要件確認書:本ページ「2.『研究機関要件確認書』」で作成したもの
・倫理審査依頼書:本ページ「3.『倫理審査依頼書』」で作成したもの
※登録方法は以下のガイドをご参照ください。
ユーザー登録方法(共通)/Webシステムへの新規申請方法(代表機関用 )/Webシステムへの新規申請方法(分担施設用)
5. 『倫理審査依頼受諾書』
Webシステムに添付された『倫理審査依頼書』を委員会事務局にて認認できましたら、本院内の決裁の上『倫理審査依頼受諾書』を発行いたします。
受領されましたら、適切に保管をお願いいたします。
※『倫理審査依頼書』と『倫理審査依頼受諾書』については、公印省略の運用となります。
公印の押印された書類での手続きが必要な場合は、別途対応いたしますのでお知らせください。
6.倫理審査
東北大学病院臨床研究倫理委員会による倫理審査を行います。
委員会からの審査意見等への対応は、基本的に代表機関の研究責任者に行なっていただきますが、各機関固有の内容については、分担施設へ確認や修正の依頼を行う場合があります。
7.審査結果通知書の発行
審査終了後、東北大学病院臨床研究倫理委員会審査結果通知書(以下、「審査結果通知書」といいます。)を発行いたします。
8.審査結果通知書の受領、研究機関の長の許可
審査結果通知書をもとに、研究機関の長(研究許可権者)より研究実施許可を得てください。
研究機関の長より研究実施許可を得た後、研究を開始してください。
審査結果通知書及び研究実施許可文書は、適切に保管をお願いいたします。
9.研究機関の長の許可の管理
研究事務局(代表機関の調整事務局)は、代表機関も含め各機関の研究実施許可通知の管理をお願いいたします。
各機関で研究実施許可がおりましたら、その情報を委員会事務局にもお知らせください。
(各分担施設の研究実施許可通知は、分担施設から代表機関の研究事務局へお知らせいただき、研究事務局から委員会事務局へお知らせください。)
介入研究の倫理審査手順フロー
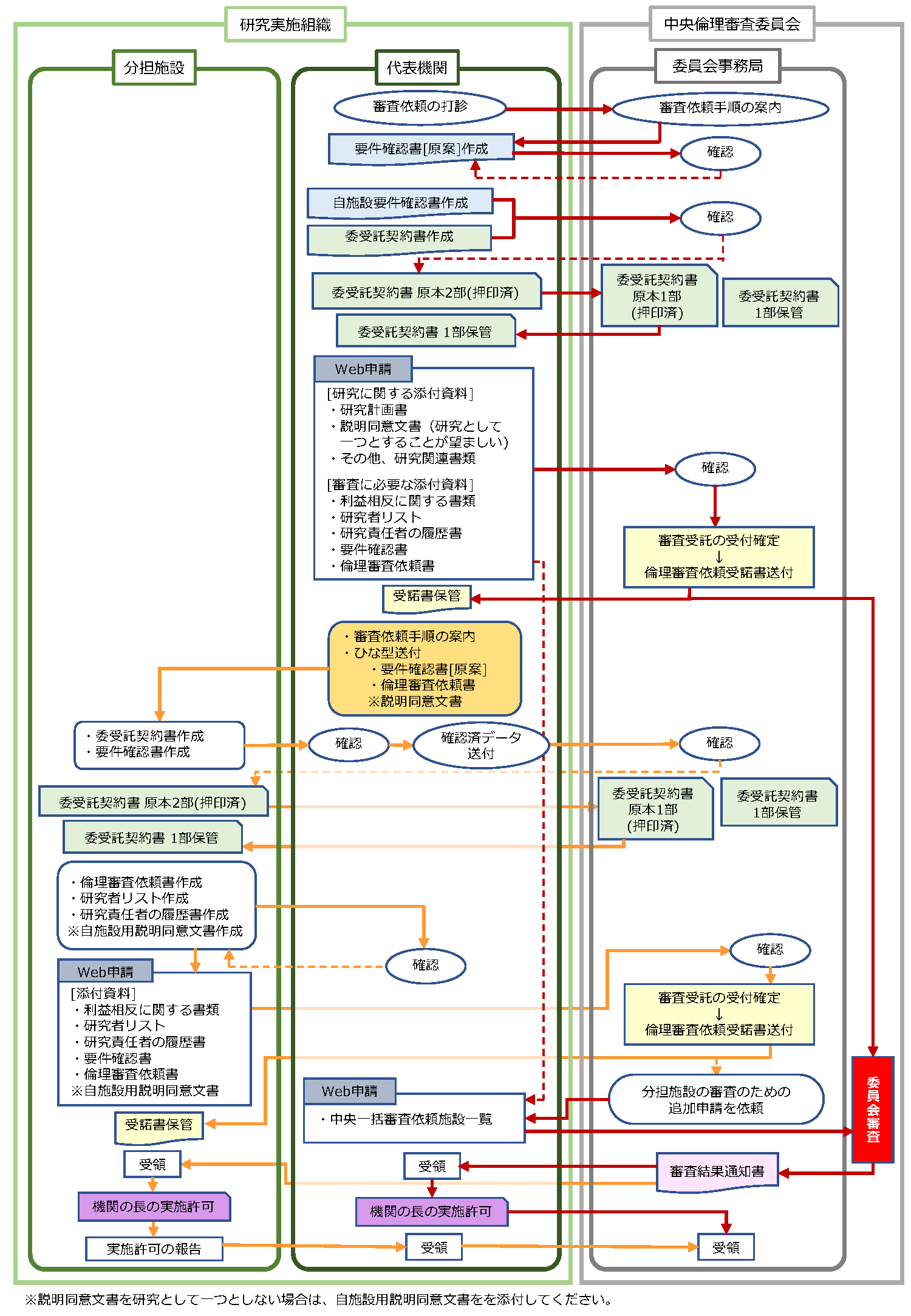
※本学が分担施設の場合、委受託契約の締結、倫理審査依頼書と倫理審査依頼受諾書の授受は不要です。