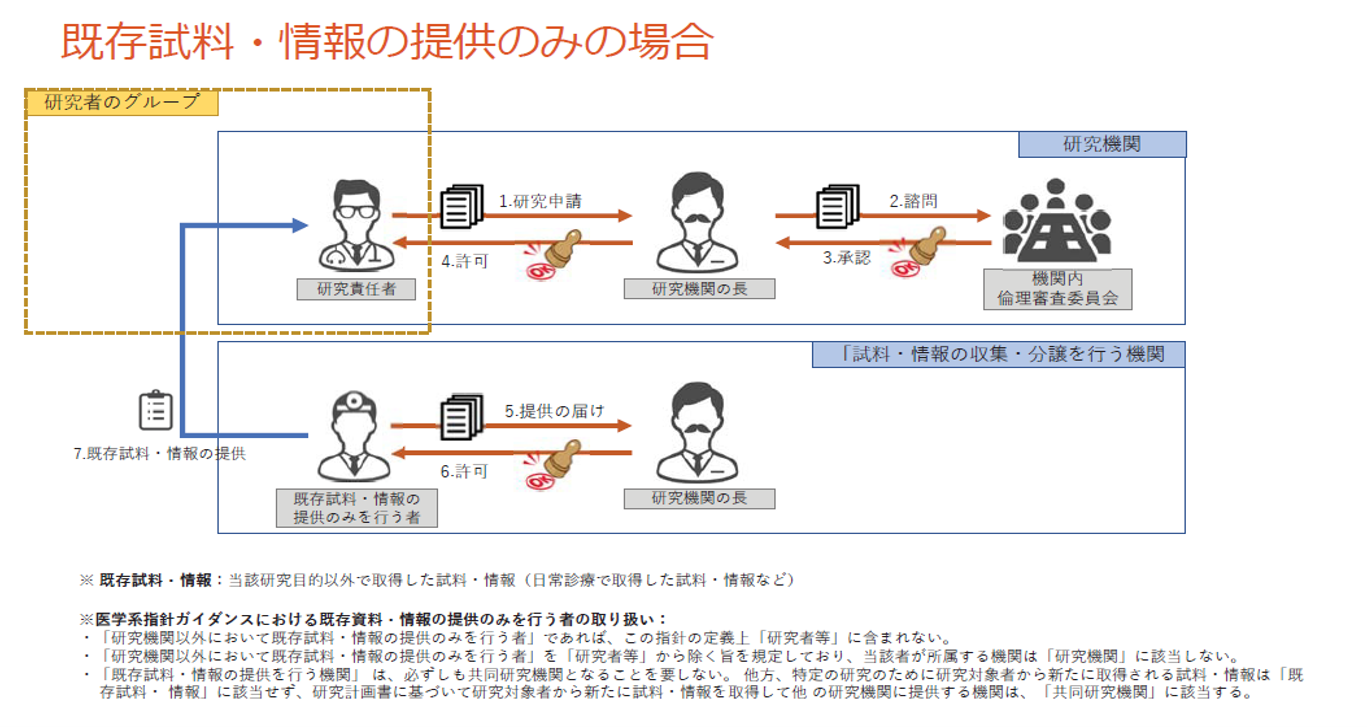
既存試料・情報の提供のみ
他機関への既存試料情報の提供のみを行う場合は、届出書を提出し(6)、研究機関の長の許可(7)後に、
対象者へ同意取得(8-1)、試料・情報の収集(8-2)を行い、既存試料・情報を提供(9)できる場合があります。
【手続き】
1.下記に該当することをご確認ください。
ご不明な場合は、「お問い合わせフォーム」より【提出書類】②~⑤ をzipにまとめてお送りください。
問い合わせ先:病院臨床研究倫理委員会事務局
2.倫理審査申請システムより下記書類を提出してください
【倫理審査申請システムからの申請方法】
申請方法は、こちらをご参照ください
倫理審査申請システム
https://www.hrp.tohoku.ac.jp/esct/
※申請後、1週間以上事務局から連絡がない場合は、お問い合わせフォームより課題名をご連絡ください。
3.事務局で申請内容を確認し、ご連絡します。
※内容を確認した結果、届出書での対応が不可の場合がございます。
予めご了承ください。
4.研究機関の長の許可がおり次第、システムよりご連絡します。
5.倫理ポータルで情報公開が行われてることを確認し、既存試料・情報の提供を行ってください。
対象者へ同意取得(8-1)、試料・情報の収集(8-2)を行い、既存試料・情報を提供(9)できる場合があります。

【手続き】
1.下記に該当することをご確認ください。
○本学は、既存試料・情報の提供のみを行い、新たに取得した試料・情報は提供しない
○本学は、共同研究機関(分担施設)ではない
※研究計画書に本学が共同研究機関として記載されている場合は、倫理審査が必要です。
○先方からの依頼文書もしくは研究計画書に倫理審査が必要である旨記載がない
※代表機関で倫理審査を求めている場合は、倫理審査が必要です。
「倫理審査後、既存試料・情報の提供を行ってください」
「倫理審査が必要」等
○提供先は、国内の機関である
※海外の場合は、「お問い合わせフォーム」より【提出書類】②~⑤ をzipにまとめてお送りください。
問い合わせ先:病院臨床研究倫理委員会事務局
○本学は、共同研究機関(分担施設)ではない
※研究計画書に本学が共同研究機関として記載されている場合は、倫理審査が必要です。
○先方からの依頼文書もしくは研究計画書に倫理審査が必要である旨記載がない
※代表機関で倫理審査を求めている場合は、倫理審査が必要です。
「倫理審査後、既存試料・情報の提供を行ってください」
「倫理審査が必要」等
○提供先は、国内の機関である
※海外の場合は、「お問い合わせフォーム」より【提出書類】②~⑤ をzipにまとめてお送りください。
問い合わせ先:病院臨床研究倫理委員会事務局
ご不明な場合は、「お問い合わせフォーム」より【提出書類】②~⑤ をzipにまとめてお送りください。
問い合わせ先:病院臨床研究倫理委員会事務局
2.倫理審査申請システムより下記書類を提出してください
【提出書類】
①他の研究機関への既存試料情報の提供に関する届出書(東北大学)
※本学の様式で作成してください
※記載例
②研究計画書
③先方(代表機関)の倫理委員会承認書写し(PDF)
※代表機関と試料・情報の提出先機関が異なる場合は、提出先機関の承認書が必要になります
④情報公開文書 (同意を取得する場合は説明文書・同意書)
※代表機関で作成されたもので構いませんが、本学仕様(本学の患者さん向け)に編集してください
※新たに作成する場合は、下記にひな型がございます。
[Ⅲ種 もしくは Ⅳ種]
⑤先方(代表機関)からの通知文書(依頼文書)一式
※メールで通知があった場合は、PDFにするもしくはWordに貼りける等して提出してください。
①他の研究機関への既存試料情報の提供に関する届出書(東北大学)
※本学の様式で作成してください
※記載例
②研究計画書
③先方(代表機関)の倫理委員会承認書写し(PDF)
※代表機関と試料・情報の提出先機関が異なる場合は、提出先機関の承認書が必要になります
④情報公開文書 (同意を取得する場合は説明文書・同意書)
※代表機関で作成されたもので構いませんが、本学仕様(本学の患者さん向け)に編集してください
<本学仕様のチェックポイント>
・対象は本学の患者さんになっていますか。
・問い合わせ先に本学の届出者は記載されていますか。
・対象は本学の患者さんになっていますか。
・問い合わせ先に本学の届出者は記載されていますか。
※新たに作成する場合は、下記にひな型がございます。
[Ⅲ種 もしくは Ⅳ種]
⑤先方(代表機関)からの通知文書(依頼文書)一式
※メールで通知があった場合は、PDFにするもしくはWordに貼りける等して提出してください。
【倫理審査申請システムからの申請方法】
申請方法は、こちらをご参照ください
倫理審査申請システム
https://www.hrp.tohoku.ac.jp/esct/
※申請後、1週間以上事務局から連絡がない場合は、お問い合わせフォームより課題名をご連絡ください。
3.事務局で申請内容を確認し、ご連絡します。
※内容を確認した結果、届出書での対応が不可の場合がございます。
予めご了承ください。
4.研究機関の長の許可がおり次第、システムよりご連絡します。
5.倫理ポータルで情報公開が行われてることを確認し、既存試料・情報の提供を行ってください。