病院長への研究実施許可申請・報告について
臨床研究法では、認定臨床研究審査委員会(以下、CRB)での審査後には各実施医療機関において当該研究を実施することの承認を管理者(当院の場合は病院長)から受ける必要があると定めています。
当院では、申請された臨床研究実施の可否は臨床研究監理センター運営会議を経て決定します。
【CRBにて承認後 当院における研究開始までの流れ】
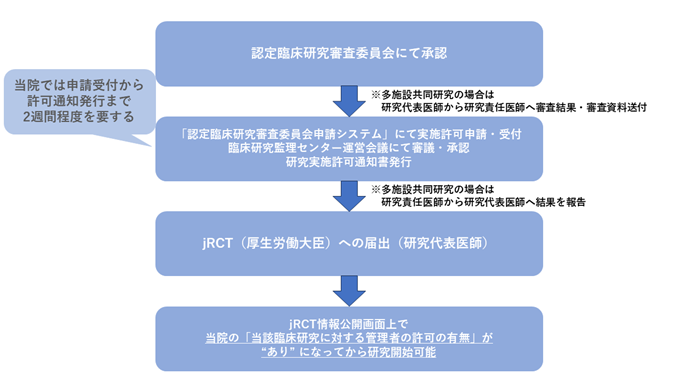
研究を開始するための新規申請以降、変更申請についても、CRBでの承認を受けたたびに実施許可申請をする必要があります。
その他、承認された各種報告も病院長への報告が必要です。
各申請・報告方法についての詳細は下記をご覧ください。
病院長報告
共通事項
1.定期報告
2.疾病等報告
3.不適合報告・重大な不適合報告
4.中止・終了通知
5.その他
・ jRCT登録・更新の報告
・【報告不要】軽微変更通知・届出外報告
CRBにおいて承認後、研究実施許可を申請してください。
当院が研究分担施設の場合、研究代表医師より審査結果と審査資料が提供されます。
※CRBで東北臨床研究審査委員会(以下、東北大CRB)と同一システム(BV Clinical-CRBシステム)を利用している場合、データの授受により申請の自動入力が可能です。
詳細はこちらをご確認ください。
【実施許可の流れ】
申請手続きは「認定臨床研究審査委員会申請システム(臨床研究法)」より行う必要があります。
「倫理審査申請システム」(医学部・歯学部・病院倫理委員会での審査申請等行うシステム)とは異なりますのでご注意ください。
➀ユーザー登録(初回のみ)
システム利用にはユーザー登録が必要です。
下記リンク「認定臨床研究審査委員会申請システム(臨床研究法)ログイン」画面から行ってください。
https://www.hrp.tohoku.ac.jp/crb/
・東北大IDをお持ちの⽅
「【東北大IDをお持ちの方】ログイン」ボタンからお進みください。
・東北大IDをお持ちでない方および東北⼤学以外に所属している⽅
「ユーザー登録(東北大IDなし、東北大学以外の方)」ボタンからお進みください。
➁新規申請入力
新規申請の具体的な入力・申請方法につきましては、こちらをご参照ください。
➂事務局確認
ご申請後、事務局で内容を確認し必要時ご修正依頼をします。ご修正完了後受付となります。
➃臨床研究監理センター運営会議での審議
受付後、臨床研究監理センター運営会議に提出されます。
研究実施許可通知書発行までには受付日よりおおよそ2週間程度を要します。
➄実施許可通知発行
許可通知は申請システムを通して発行され、「新規申請 実施許可結果のお知らせ」メールが配信されます。
通知書確認方法はこちらをご確認ください。
許可通知後、当院が研究分担施設の場合は研究代表医師へご報告をお願いします。
➅研究開始
研究代表医師がjRCTに届出を行いますので、jRCT情報公開画面上で当院の「管理者の許可の有無」が“あり” になっていることを確認してから研究を開始してください。
併せて、jRCT登録について病院長への報告が必要です。
報告方法の詳細につきましてはその他報告(jRCT登録・更新の報告)をご参照ください。
変更申請がCRBで承認されたたびに病院長への実施許可申請が必要です。
当院が研究分担施設の場合は、審査結果と審査資料が研究代表医師より提供されますので遅滞なく実施許可を申請してください。
※CRBで東北大CRBと同一システム(BV Clinical-CRBシステム)を利用している場合、データの授受により申請の自動入力が可能です。
詳細はこちらをご確認ください。
上記に該当しない場合、変更申請を下記の手順で行ってください。
認定臨床研究審査委員会申請システム(臨床研究法)へログイン
>メインメニュー内 申請者用メニュー
「実施許可課題一覧」内 該当課題【表示】ボタン押下
>「研究課題詳細表示」画面内 下部 申請メニュー
変更申請【→】ボタン押下
必要事項ご入力、今回の承認資料および「病院様式1 研究実施許可申請書」を添付の上ご申請ください。
研究実施許可申請書は「その他添付資料」欄に添付してください。
下記リンクからテンプレートをダウンロード可能です。
https://www.rinri.med.tohoku.ac.jp/portal/tejyun.html
記載例・ご作成時の留意点につきましては下記をご覧ください。
https://www.rinri.med.tohoku.ac.jp/portal/files/pdf1.pdf 2025/07/22更新
※承認資料のうち、やむを得ず提供できないものがある場合には、その事由について「研究実施許可申請書」の備考欄に記載してご提出ください。
記載例)〇〇(資料名)に関して、個人情報保護のため他施設分は研究代表施設からの提供なし。
作成した研究実施許可申請書は「その他添付資料」欄に添付してください。
申請基本情報(システム編集画面)におきましても、変更があった項目についてはご編集をお願いします。
たびたび変更される項目の例:
研究名称、区分4(多施設共同研究)欄 医療機関数、当院における研究責任(代表)医師、研究期間
ご申請後、事務局で内容を確認します。必要時ご修正依頼をし、ご修正完了後受付します。
その後臨床研究監理センター運営会議に提出されます。
研究実施許可通知書発行までには受付日よりおおよそ2週間程度を要します。
許可通知は申請システムを通して発行され、「変更申請 実施許可結果のお知らせ」メールが配信されます。
通知書確認方法はこちらをご確認ください。
許可通知後、当院が研究分担施設の場合は研究代表医師へご報告をお願いします。
※CRBで東北大CRBと同一システム(BV Clinical-CRBシステム)を利用している場合、データの授受により報告の自動入力が可能です。
詳細はこちらをご確認ください。
※東北大CRBにて審査されており、研究代表医師が当院所属の研究においては定期報告、疾病等報告、重大な不適合報告は自動で病院長報告がなされますのでお手続きは不要です。
上記に該当しない場合、下記の手順で報告を行ってください。
認定臨床研究審査委員会申請システム(臨床研究法)へログイン
>メインメニュー内 申請者用メニュー
「実施許可課題一覧」内 該当課題【表示】ボタン押下
>「研究課題詳細表示」画面内 下部 申請メニュー
該当報告 右の【→】ボタン押下
必要事項ご入力、今回の承認資料および「病院様式3 報告事項提出書」を添付の上ご申請ください。
下記リンクから報告事項提出書テンプレートをダウンロード可能です。
https://www.rinri.med.tohoku.ac.jp/portal/tejyun.html
下記は記載例です。
https://www.rinri.med.tohoku.ac.jp/portal/files/pdf3.pdf 2025/07/22更新
報告事項提出書の「添付資料」欄には添付したすべての資料名と日付(承認日、作成年月日等)をご記載ください。
作成した報告事項提出書は「その他添付資料」欄に添付してください。
ご申請後、事務局で内容を確認し必要時ご修正依頼をします。
ご修正完了後受付し、病院長報告のお手続きは完了となります。
ご報告は原則として臨床研究監理センター運営会議に提出され、病院長を含む委員が内容を確認します。
(原則として)実施計画を厚生労働大臣に提出した日から起算して1年ごとに研究代表医師が定期報告を行います。CRBにて承認後、病院長報告をしてください。
当院が研究分担施設の場合は、審査結果と審査資料が研究代表医師より提供されますので遅滞なく病院長報告をしてください。
〈当院が代表施設の場合の留意点〉
・東北大CRBにて審査されており、研究代表医師が当院所属の研究は自動で病院長報告がなされますので定期報告についてのお手続きは不要です。
・学外CRBにて審査されており、研究代表医師が当院所属の課題は「CRB審査前」「CRB審査後」の2回病院長報告が必要です。
➀CRB審査前
審査前の報告では、CRBへ提出する資料一式と「病院様式3 報告事項提出書」を添付してください。
➁CRB審査後
審査前の病院長報告完了後、当該報告のロックは解除されます。
審査完了後、再度編集画面へ進み、下記を添付の上【申請】ボタンを押下してください。審査後の病院長報告が行われます。
・審査結果通知書および関連資料
・「病院様式3 報告事項提出書」※審査後の報告用に新たに1通作成し添付してください。
※審査前の報告時に添付した資料は削除や編集等されませんようご注意ください。
研究責任医師は、疾病等(不具合を含む)の発生を知った場合、定められた期限内(※)にその旨を当該医療機関の管理者に報告する必要があります。
多施設共同研究で当院が研究分担施設の場合、加えて研究代表医師へ報告してください。
※期限の詳細は下記ページに掲載されている手順書内「19.4 認定臨床研究審査委員会への疾病等報告」をご確認ください。
・東北大学病院における臨床研究に関する手順書:
https://www.rinri.med.tohoku.ac.jp/portal/tejyun.html
※当院では、臨床研究法に則り当該特定臨床研究の実施との関連性が否定「できる」疾病等は病院長への報告を不要としています。ただし報告が必要と判断する場合に、それを妨げるものではありません。
※東北大CRBにて審査している課題のうち、研究代表医師が当院所属の場合は自動で病院長報告がなされますので疾病等報告についてのお手続きは不要です。
当院が研究分担施設であって、他施設で発生した疾病等(不具合を含む)がCRBにて報告された場合は、審査結果と審査資料が研究代表医師より提供されましたら遅滞なく病院長報告をしてください。
研究責任医師は、省令⼜は研究計画書に適合していない状態(不適合)であると知ったときは速やかに病院長に報告する必要があります。
特に、対象者の人権、安全性、研究の進捗、結果の信頼性に影響を及ぼすものは重大な不適合報告となりCRBへ速やかに報告しなければなりません。多施設共同研究で当院が研究分担施設の場合速やかに研究代表医師に報告してください。
不適合の定義・報告手続き等の詳細は下記ページに掲載されている手順書をご確認ください。
東北大学病院における臨床研究に関する標準業務手順書(SOP)第4章 不適合事例への対応:
https://www.rinri.med.tohoku.ac.jp/portal/tejyun.html
※東北大CRBにて審査している課題のうち、研究代表医師が当院所属の場合は重大な不適合報告に限り自動で病院長報告がなされますのでお手続きは不要です。
(重大でない)不適合報告は申請者ご自身で病院長報告を行ってください。
CRBにて承認後、病院長報告をしてください。
当院が研究分担施設の場合は、審査結果と審査資料が研究代表医師より提供されますので遅滞なく病院長報告をしてください。
〈終了通知を申請される場合の留意点〉
終了通知を申請(または一時保存)した時点で、システムの仕様上変更申請など他の申請・報告はできなくなります。これまでの申請・報告が漏れなく行われているかご確認の上終了通知を作成してください。
当院での新規申請後、jRCT情報公開画面上で当院の「管理者の許可の有無」が“あり” になりましたらご報告をお願いします。
詳細はこちらをご確認ください。
その後の(当院初回登録以降の)jRCT更新報告は必須ではありませんが、進捗管理等の為ご提出いただいても問題ありません。
2022年4月の法改正に伴い軽微変更の対象が拡大したことから同年5月に「東北大学病院における臨床研究に関する手順書」が改訂され軽微変更及び届出外変更について病院長への通知は不要となりました。
詳細は下記ページに掲載されている手順書内の「14.5.実施計画の軽微な変更」および「14.6.実施計画を変更しないjCRTの変更(届出外変更)」をご確認ください。
・東北大学病院における臨床研究に関する手順書:
https://www.rinri.med.tohoku.ac.jp/portal/tejyun.html
※ただし、軽微変更の報告を希望する場合は下記のようにご報告ください。
認定臨床研究審査委員会申請システム(臨床研究法)へログイン
>メインメニュー内 申請者用メニュー
「実施許可課題一覧」内 該当課題【表示】ボタン押下
>「研究課題詳細表示」画面内 下部 申請メニュー
軽微変更通知【→】ボタン押下
・資料一式(統一書式14 軽微変更通知書、様式第三 実施計画事項軽微変更届書、様式第一 臨床研究実施計画届書等)
・病院様式3 報告事項提出書(※「報告事項」欄は「その他」にチェックし、括弧内には「軽微変更通知」等記載)
を添付の上申請
*研究実施許可・各種ご報告についてのお問い合わせ
臨床研究実施許可担当:crbkyoka-hosp@grp.tohoku.ac.jp